LDL-c niveau geassocieerd met vroeg optreden van ziekte van Alzheimer
Er is een verband tussen hoog LDL-c en vroege ZvA, onafhankelijk van APOE E4. Nieuwe zeldzame genetische varianten werden gevonden in APOB, die niet volledig dit verband verklaren.
Association of Early-Onset Alzheimer Disease With Elevated Low-density Lipoprotein Cholesterol Levels and Rare Genetic Coding Variants of APOBLiteratuur - Wingo TS, Cutler DJ, Wingo AP et al., - JAMA Neurol. 2019. doi:10.1001/jamaneurol.2019.0648
Introductie en methoden
Vroeg optreden van de ziekte van Alzheimer (early onset Alzheimer disease: EOAD) is een vorm van de ZvA die zich manifesteert voor het 65e jaar. Erfelijkheid van deze zeldzame vorm is 91% tot 100% [1]. ZvA-veroorzakende mutaties zijn geïdentificeerd in de amyloid precursor proteïne (APP), preseniline 1 (PSEN1) en preseniline 2 (PSEN2) genen, maar het is niet duidelijk in hoeverre deze genen bijdragen aan EOAD [2]. Waarschijnlijk is minder dan 10% van de incidente EOAD gevallen gerelateerd aan deze genen, wat betekent dat ongeveer 90% van de EOAD gevallen onverklaard zijn [1-3].
Diverse soorten bewijsvoering hebben gesuggereerd dat er een verband is tussen hoger risico op laat optreden van ZvA (LOAD). Deze studie beoogde de rol van circulerend cholesterol in relatie tot EOAD te onderzoeken. EOAD is geassocieerd met het apolipoproteïne E ε4 allel (APOE E4), waarvan bekend is dat het circulerend cholesterol verhoogd, met name LDL-c [4,5]. Verhoogde cholesterolniveaus op middelbare leeftijd zijn gezien in relatie tot hoger risico op ZvA en cognitieve achteruitgang, in epidemiologische studies, zelfs na correctie voor APOE E4 [6-12]. Cholesterolverlagende therapie is in verband gebracht met een lager risico op ZvA, onafhankelijk van APOE E4 [13].
Om nieuwe oorzaken van EOAD op te sporen, onderzocht deze studie de bijdrage van de vier genoemde bekende mutaties in 2125 patiënten met EOAD en controles. De onderzoekers bestudeerden ook of verschillende fracties van circulerende plasmalipoproteïnes geassocieerd waren met EOAD na correctie voor APOE E4 in 267 EOAD cases en controles. Na de bevinding dat EOAD geassocieerd was met hogere niveaus van totaal cholesterol (TC), LDL-c en plasma apolipoproteïne B (ApoB), voerden de onderzoekers grootschalig gerichte sequencing uit van APOB in de 2125 cases en controles, aangezien van zeldzame varianten in dit gen bekend is dat ze in sterke mate LDL-c niveaus beïnvloeden [14-16].
EOAD werd gedefinieerd als waarschijnlijk of definitief op basis van de National Institute of Neurological and Communicative Diseases and Stroke–Alzheimer’s Disease and Related Disorders Association Work Group criteria [17], waarbij symptomen begonnen op of voor 65-jarige leeftijd (gemiddeld: 55.6, SD: 4.3). Controles cognitief normale individuen van 60 jaar en ouder (gemiddeld: 72.0, SD: 9.6).
Belangrijkste resultaten
- Deep sequencing in 2125 monsters identificeerde 13 eerder beschreven ZvA-veroorzakende mutaties, in 23 individuen, waaronder 2 sites in APP (n=2), 10 sites in PSEN1 (n=18) en 2 sites in PSEN2 (n=3).
- Een gen-gebaseerde burden-analyse van zeldzame coderende varianten van APP, PSEN1 en PSEN2 legde alleen voor PSEN1 een significante associatie bloot, hoewel in alle drie de genen goed beschreven pathogene mutaties werden gevonden.
- De discovery data set (n=318) toonde geen verrijking voor PSEN1, maar de grotere replicatiedatasets lieten wel een significant verband zien. Verdere analyses suggereerden dat bekende ZvA-veroorzakende mutaties dit verband verklaren. In analyses om nieuwe associaties op te sporen, warden dragers van de de bekende ZvA-mutaties geëxcludeerd.
- 75.1% van de EOAD gevallen droeg het APOE E4 allel, in vergelijking met 30.5% van de controles.
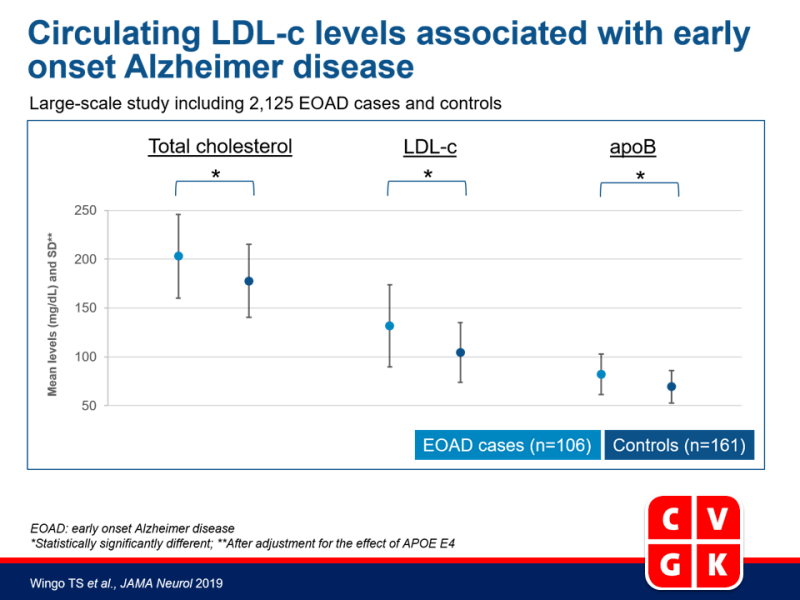
- Zelfs na rekening te houden met het effect van APOE E4, hadden EOAD cases significant hoger gemiddeld TC (203.0 [SD: 42.7] vs. 177.7 [SD: 37.2] mg/dL), LDL-c (131.6 [SD: 41.9] vs. 104.4 [30.6] mg/dL) en plasma ApoB (82.2 [SD: 20.8] vs. 69.3 [SD: 16.6] mg/dL) dan controles. Er werden geen significante associaties gezien tussen EOAD en HDL-c of triglyceridenniveaus. Geschat werd dat LDL-c niveaus 7.6% van de variantie in vatbaarheid voor EOAD verkaren, onafhankelijk van APO E4.
- Een zoektocht naar APOB varianten geassocieerd met veranderingen in codering leverde een sterk verband op tussen APOB en EOAD, onafhankelijk van APOE E4.
- 57 Zeldzame APOB coderende varianten, waarvan 33 werden gezien in 31 EOAD cases en 24 in 24 controles (geen gemeenschappelijke varianten) lieten zien dat 5% van de EOAD patiënten drager was van een variant allel, ten opzichte van 1.7% van de controles. Er waren geen aanwijzingen dat specifieke domeinen in ApoB gerelateerd waren aan LDL-c levels in EOAD cases of controles.
Conclusie
Deze studie vond dat ongeveer 3.4% van alle patiënten met EOAD drager zijn van een bekende ZvA-veroorzakende variant, maar dat alleen zeldzame coderende varianten in PSEN1 geassocieerd waren met EOAD. Het sterke verband tussen APOE E4 en EOAD werd bevestigd in deze dataset. Bovendien werd een robuuste associatie gevonden tussen verhoogde LDL-c niveaus en EOAD, onafhankelijk van APOE E4. Zeldzame genetische coderende varianten van APOB kwamen vaker voor in EOAD patiënten dan in controles, maar dit kon niet volledig het verband tussen hogere LDL-c niveaus en EOAD verklaren, hetgeen doet vermoeden dat nog andere genen en/of mechanismen hierbij betrokken zijn.
Redactioneel commentaar
In een redactioneel commentaar merkt Makato Ishii [18] op dat EOAD patiënten vaak worden uitgesloten van onderzoek naar ZvA, als gevolg van de lage prevalentie van de aandoening. Omdat de geschatte erfelijkheid van EOAD aanzienlijk hoger is dan die van LOAD, en omdat tot dus ver opgespoorde mutaties maar ongeveer 11% van de EOAD gevallen verklaren, is het waarschijnlijk dat er nog meer ZvA-gevoeligheidsgenen zullen worden opgespoord. De studie van Wingo en collega’s bevestigt dat de vier geteste ZvA-gevoeligheidsgenen maar een klein deel van de sterke genetische aanleg voor EOAD verklaren.
De studie levert het eerste bewijs dat zeldzame genetische coderende varianten van APOB sterk geassocieerd zijn met EOAD, maar de data suggereren ook dat er waarschijnlijk andere bijdragende factoren zijn, onafhankelijk van APOB en APOE. Kandidaten hiervoor zijn mogelijk zeldzame varianten van andere genen die die betrokken zijn bij LDL-c metabolisme, of factoren die circulerende LDL-c niveaus beïnvloeden. Aanvullende studies zijn nodig om het verband tussen LDL-c en EOAD verder te ontrafelen. Zoals de auteurs ook opmerken, is onbekend of ook beschermende varianten van APOB bestaan. Het opsporen van een dergelijke variant zou het verband tussen APOB en ZvA-pathogenese verder versterken. Verbanden tussen andere CV risicofactoren en EOAD verdienen ook studie en zullen mogelijk evenzeer interessante inzichten opleveren.
Ishii merkt op dat het een sterk punt van deze studie is dat alle deelnemers werden geïncludeerd in de 19 Amerikaanse Alzheimer’s Disease Reseach Centre, die werken met gestandaardiseerde onderzoek- en diagnoseprotocollen. Desalniettemin zijn er ook enkele beperkingen, zoals dat de diagnose ZvA werd gesteld op basis van klinische criteria, zonder gebruik van neuro-imagingtechnieken of ZvA-biomarkers in hersenvocht. Hierdoor kan EOAD verkeerd geclassificeerd worden wanneer het een niet-ZvA dementie betreft. De studiepopulatie bestond alleen uit witte mensen, omdat er te weinig monsters waren van mensen met een andere etnische achtergrond. Bovendien werden factoren die plasmacholesterolniveaus beïnvloeden, zoals inname via dieet, medicatie en hormonen niet beschouwd.
Meer studies zoals die van Wingo et al. zouden uitgevoerd moeten worden. Niet alleen om extra kandidaatgenen betrokken bij ZvA te identificeren, maar ook om verschillen tussen EOAD en LOAD te vinden, die uiteindelijk tot beter management en zorg van patiënten met EOAD te maken hebben.
Referenties
1. Wingo TS, Lah JJ, Levey AI, Cutler DJ. Autosomal recessive causes likely in early-onset Alzheimer disease. Arch Neurol. 2012;69(1):59-64. doi:10.1001/archneurol.2011.221
2. Cacace R, Sleegers K, Van Broeckhoven C. Molecular genetics of early-onset Alzheimer’s disease revisited. Alzheimers Dement. 2016;12(6): 733-748. doi:10.1016/j.jalz.2016.01.012
3. Campion D, Dumanchin C, Hannequin D, et al. Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum. Am J Hum Genet. 1999;65(3): 664-670. doi:10.1086/302553
4. van Duijn CM, de Knijff P, Cruts M, et al. Apolipoprotein E4 allele in a population-based study of early-onset Alzheimer’s disease. Nat Genet. 1994;7(1):74-78. doi:10.1038/ng0594-74
5. Chasman DI, Paré G, Mora S, et al. Forty-three loci associated with plasma lipoprotein size, concentration, and cholesterol content in genome-wide analysis. PLoS Genet. 2009;5(11): e1000730. doi:10.1371/journal.pgen.1000730
6. Kivipelto M, Solomon A. Cholesterol as a risk factor for Alzheimer’s disease: epidemiological evidence. Acta Neurol Scand Suppl. 2006;185:50-57. doi:10.1111/j.1600-0404.2006.00685.x
7. Shepardson NE, Shankar GM, Selkoe DJ. Cholesterol level and statin use in Alzheimer disease, I: review of epidemiological and preclinical studies. Arch Neurol. 2011;68(10):1239-1244. doi:10.1001/archneurol.2011.203
8. Kivipelto M, Helkala EL, Laakso MP, et al. Apolipoprotein E 4 allele, elevated midlife total cholesterol level, and high midlife systolic blood pressure are independent risk factors for late-life Alzheimer disease. Ann Intern Med. 2002;137(3): 149-155. doi:10.7326/0003-4819-137-3-200208060-00006
9. Notkola IL, Sulkava R, Pekkanen J, et al. Serum total cholesterol, apolipoprotein E 4 allele, and Alzheimer’s disease. Neuroepidemiology. 1998;17 (1):14-20. doi:10.1159/000026149
10. Kalmijn S, Foley D, White L, et al. Metabolic cardiovascular syndrome and risk of dementia in Japanese-American elderly men: the Honolulu-Asia Aging Study. Arterioscler Thromb Vasc Biol. 2000; 20(10):2255-2260. doi:10.1161/01.ATV.20.10.2255
11. Whitmer RA, Sidney S, Selby J, et al. Midlife cardiovascular risk factors and risk of dementia in late life. Neurology. 2005;64(2):277-281. doi:10.1212/01.WNL.0000149519.47454.F2
12. Jarvik GP, Wijsman EM, Kukull WA et al. Interactions of apolipoprotein E genotype, total cholesterol level, age, and sex in prediction of Alzheimer’s disease: a case-control study. Neurology. 1995;45(6):1092-1096. doi:10.1212/WNL.45.6.1092
13. HaagMD, Hofman A, Koudstaal PJ, et al. Statins are associated with a reduced risk of Alzheimer disease regardless of lipophilicity: the Rotterdam Study. J Neurol Neurosurg Psychiatry. 2009;80(1):13-17. doi:10.1136/jnnp.2008.150433
14. Peloso GM, Auer PL, Bis JC, et al; NHLBI GO Exome Sequencing Project. Association of low-frequency and rare coding-sequence variants with blood lipids and coronary heart disease in 56,000 whites and blacks. Am J Hum Genet. 2014; 94(2):223-232. doi:10.1016/j.ajhg.2014.01.009
15. Lange LA, Willer CJ, Rich SS. Recent developments in genome and exome-wide analyses of plasma lipids. Curr Opin Lipidol. 2015;26(2):96-102. doi:10.1097/MOL.0000000000000159
16. Lange LA, Hu Y, Zhang H, et al; NHLBI Grand Opportunity Exome Sequencing Project. Whole-exome sequencing identifies rare and low-frequency coding variants associated with LDL cholesterol. Am J Hum Genet. 2014;94(2):233-245.doi:10.1016/j.ajhg.2014.01.010
17. McKhann G, Drachman D, Folstein M et al. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDAWork Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology. 1984;34 (7):939-944. doi:10.1212/WNL.34.7.939
18. Ishii M. Apolipoprotein B as a New Link Between Cholesterol and Alzheimer Disease. JAMA Neurol. 2019. doi:10.1001/jamaneurol.2019.0212
