Exenatide of glimepiride na metformine in type 2 diabetes
Hoewel metformine eerstelijns therapie is voor patiënten met type 2 diabetes, faalt de glykemische controle met metformine alleen bij veel patiënten. Een open-label gerandomiseerde gecontroleerde studie werd uitgevoerd, waarin add-on exenatide werd vergeleken met add-on glimepiride bij patiënten die onvoldoende glykemische controle bereikten met metformine alleen.
Exenatide twice daily versus glimepiride for prevention of glycaemic deterioration in patients with type 2 diabetes with metformin failure (EUREXA): an open-label, randomised controlled trial.Literatuur - Gallwitz B, Guzman J, Dotta F, et al.; Lancet. 2012 Jun 8
Gallwitz B, Guzman J, Dotta F, et al.
Lancet. 2012 Jun 8. [Epub ahead of print]
Achtergrond
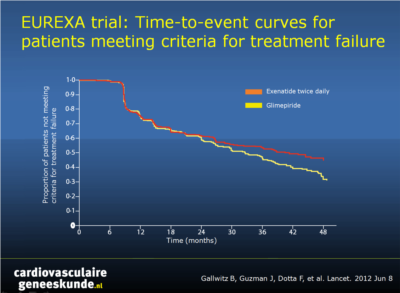
Hoewel metformine eerstelijns therapie is voor patiënten met type 2 diabetes [1,2], faalt de glykemische controle met metformine alleen bij veel patiënten. Glimepiride is een sulfonylureumderivaat, dat vaak wordt voorgeschreven aan dergelijke patiënten [1,3,4]. Het risico van hypoglykemie kan de dosering die wordt gebruikt in de klinische praktijk beperken [5]. Exenatide is een glucagon-like peptide-1 (GLP-1) agonist die de glykemische controle verbetert met glucose-afhankelijke stimulatie van de insulinesecretie, zonder verhoogd risico op hypoglykemie. Een open-label gerandomiseerde gecontroleerde studie werd uitgevoerd bij 128 centra in 14 landen, waarin add-on exenatide werd vergeleken met add-on glimepiride bij patiënten die onvoldoende glykemische controle bereikten met metformine alleen. Een totaal van 515 patiënten werden gerandomiseerd naar exenatide tweemaal per dag, werden 514 op glimepiride, de intent-to-treat analyse omvatte 490 en 487 patiënten.De primaire uitkomstmaat was de tijd tot onvoldoende glykemische controle en de noodzaak voor een alternatieve behandeling, gedefinieerd als een HbA1c van meer dan 9% na 3 maanden, of een HbA1c hoger dan 7% bij twee opeenvolgende bezoeken drie maanden uit elkaar.
Belangrijkste resultaten
- In de exenatide-groep ervoeren 203 van 490 patiënten (41%) falen van de behandeling, in vergelijking met 262 patiënten van 487 (54%) in de glimepiride-groep (risicoverschil, 12,4, 95% betrouwbaarheidsinterval [BI], 6,2 tot 18,6; hazard ratio, 0,748 [95% CI, 0,623 tot 0,899], p = .002).
- Significant meer patiënten die exenatide gebruikten, bereikten een HbA1c lager dan 7% (45% versus 31%, P <0,0001) en 6,5% of minder (29% versus 18%, P = 0,0001).
- Exenatide patiënten hadden ook een significant grotere afname in lichaamsgewicht – zij verloren 3,32 kg in vergelijking met een toename van 1,15 kg voor degenen die glimepiride gebruikten (P <0,0001) - en aanzienlijk minder hypoglykemie (P <0,0001).
- Meer patiënten die exenatide gebruikten hadden bijwerkingen, voornamelijk gastro-intestinale effecten zoals misselijkheid en diarree, en beëindigden de therapie. De meeste bijwerkingen deden zich voor binnen de eerste 6 maanden van de behandeling (P = 0,0005).
Conclusie
Tweemaal daags exenatide bleek gunstiger dan de gebruikelijke behandeling met glimepiride in het voorkomen van de verslechtering van de glykemische controle bij patiënten met type 2 diabetes.
Redactioneel commentaar [8]
Sterke punten van het onderzoek waren de lange-termijn follow-up en de vergelijking tussen vaak gebruikte middelen. Slechts weinig studies hebben anti-diabetische geneesmiddelen vergeleken op de duurzaamheid van hun effectiviteit op de glykemische controle, kosten, kwaliteit van leven, en hun effecten op late diabetische complicaties.GLP-1 receptor agonisten hebben tot nu toe cardioprotectieve effecten getoond en vermindering van markers voor ontsteking, hoewel overheden nieuwe resultaten voor cardiovasculaire risico's met deze middelen in de nabije toekomst nauwlettend in de gaten houden.
Referenties
1. Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32: 193–203
2. Holman RR, Paul SK, Bethel MA Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–89.
3. International Diabetes Federation. Global guideline for type 2 diabetes. 2005. http://www.idf.org/guidelines/type-2-diabetes (accessed Jan 19, 2012).
4. International Diabetes Federation. Treatment algorithm for people with type 2 diabetes. 2011. http://www.idf.org/treatment-algorithmpeople-type-2-diabetes (accessed Jan 19, 2012).
5. Kahn SE, Haff ner SM, Heise MA, et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355: 2427–43.
6. Drucker DJ, Sherman IS, Gorelick FS, et al. Incretin-based therapies for the treatment of type 2 diabetes: evaluation of the risks and benefi ts. Diabetes Care 2010;33: 428–33.
7. Tahrani AA, Bailey CJ, Del Prato S, Barnett AH. Management of type 2 diabetes: new and future developments in treatment. Lancet 2011; 378: 182–97.
8. Madsbad S. Type 2 diabetes: which drug as add-on to metformin? Lancet. 2012 Jun 8. [Epub ahead of print]
Abstract
BACKGROUND:In people with type 2 diabetes, a dipeptidyl peptidase-4 (DPP-4) inhibitor is one choice as second-line treatment after metformin, with basal insulin recommended as an alternative. We aimed to compare the efficacy, tolerability, and safety of insulin glargine and sitagliptin, a DPP-4 inhibitor, in patients whose disease was uncontrolled with metformin.
METHODS:
In this comparative, parallel, randomised, open-label trial, metformin-treated people aged 35-70 years with glycated haemoglobin A(1c) (HbA(1c)) of 7-11%, diagnosis of type 2 diabetes for at least 6 months, and body-mass index of 25-45 kg/m(2) were recruited from 17 countries. Participants were randomly assigned (1:1) to 24-week treatment with insulin glargine (titrated from an initial subcutaneous dose of 0•2 units per kg bodyweight to attain fasting plasma glucose of 4•0-5•5 mmol/L) or sitagliptin (oral dose of 100 mg daily). Randomisation (via a central interactive voice response system) was by random sequence generation and was stratified by centre. Patients and investigators were not masked to treatment assignment. The primary outcome was change in HbA(1c) from baseline to study end. Efficacy analysis included all randomly assigned participants who had received at least one dose of study drug and had at least one on-treatment assessment of any primary or secondary efficacy variable. This trial is registered at ClinicalTrials.gov, NCT00751114.
FINDINGS:
732 people were screened and 515 were randomly assigned to insulin glargine (n=250) or sitagliptin (n=265). At study end, adjusted mean reduction in HbA(1c) was greater for patients on insulin glargine (n=227; -1•72%, SE 0•06) than for those on sitagliptin (n=253; -1•13%, SE 0•06) with a mean difference of -0•59% (95% CI -0•77 to -0•42, p<0•0001). The estimated rate of all symptomatic hypoglycaemic episodes was greater with insulin glargine than with sitagliptin (4•21 [SE 0•54] vs 0•50 [SE 0•09] events per patient-year; p<0•0001). Severe hypoglycaemia occurred in only three (1%) patients on insulin glargine and one (<1%) on sitagliptin. 15 (6%) of patients on insulin glargine versus eight (3%) on sitagliptin had at least one serious treatment-emergent adverse event.
INTERPRETATION:
Our results support the option of addition of basal insulin in patients with type 2 diabetes inadequately controlled by metformin. Long-term benefits might be expected from the achievement of optimum glycaemic control early in the course of the disease.