Klinische karakteristieken, behandelpatronen en uitkomsten in real-world HFrEF patiënten met verslechterend HF
In de dagelijkse praktijk hadden HFrEF patiënten met verslechterend HF een grotere comorbiditeitslast en slechte uitkomsten, met laag waargenomen medicatiegebruik en suboptimale dosering voor en na events die HF verslechteren.
Clinical Course of Patients With Worsening Heart Failure With Reduced Ejection FractionLiteratuur - Butler J, Yang M, Manzi MA et al. - JACC 2019;73(8): 935-44
Introductie en methoden
Hartfalen (HF) is een inherent progressieve klinische aandoening. Het wordt verondersteld dat verslechterend HF, gekenmerkt door ontwikkeling van progressief escalerende symptomen en tekenen van HF die intraveneuze diureticatherapie vereisen in de polikliniek, spoedeisende hulp of in het ziekenhuis, geassocieerd is met een duidelijk slechte prognose [1-4].
Vanwege een hoog risico op nadelige uitkomsten, is er een groeiende belangstelling voor klinische trials met nieuwe interventies uitgevoerd in zowel acute als chronische omstandigheden in individuen met verslechterend HF [5]. Data van HF patiënten met verminderde ejectiefractie (HFrEF) en verslechterend HF zijn echter voornamelijk verkregen uit databases van klinische trials of registers die beperkt zijn tot het ziekenhuistraject van de patiënt, waardoor een beperkt begrip van dit belangrijke, groeiende en dure probleem wordt verkregen. Deze cohortanalyse van gekoppelde register- en verzekering-gebaseerde data onderzocht daarom de epidemiologie, demografische en klinische karakteristieken, behandelpatronen en uitkomsten in patiënten met HFrEF, die verslechterend HF ontwikkelden.
Deze analyse (n=1.851) includeerde data van patiënten ≥18 jaar met incidente HFrEF (LVEF ≤45%; gediagnosticeerd tussen jan 2011-dec 2014) van de National Cardiovascular Data Registry (NCDR) PINNACLE die werden gevolgd (tot juni 2016) om verslechterende HF events te bepalen. Deze data werden gekoppeld aan data van de Symphony Health (SH) verzekeringsdatabases. Patiënten met verslechterend HF werden gedefinieerd als diegenen die: ≥30 dagen initiële HF therapie kregen na de diagnose van HFrEF, geen HF-gerelateerde spoedeisende hulp, ziekenhuisopname en poliklinische intraveneuze diureticatoediening hadden gekregen voor ≥90 dagen na de diagnose van HFrEF, en vervolgens ≥1 intraveneuze diureticabehandeling nodig hadden in een zorginstelling of een HF-gerelateerde ziekenhuisopname. Medicatiegebruik werd beoordeeld 3 maanden voor, tijdens en 6 maanden na het chronische verslechterede HF event. Sterfte door alle oorzaken en ziekenhuisopname voor HF, en het aantal ziekenhuisheropnames voor HF werden onderzocht gedurende een follow-upduur van 2 jaar na chronische verslechterende HF event.
Van de 11.064 geschikte HFrEF patiënten, ontwikkelde 16.7% verslechterend HF gedurende de studieperiode (gemiddelde 1.5 jaar) vanaf de eerste diagnose van HF.
Belangrijkste resultaten
Comorbiditeiten
- In 94% van alle patiënten en in 100% van diegenen met verslechterend HF werd minstens één comorbiditeit gezien.
- Patiënten die verslechterend HF ontwikkelden hadden vaker hypertensie (78.6% vs. 68.2%), CAD (63.5% vs. 52.8%), dyslipidemie (58.1% vs. 53.6%), AF/flutter (47.9% vs. 36.4%), diabetes mellitus (45.9% vs. 36.1%), MI (33.2% vs. 23.8%), COPD (28.9% vs. 16.6%), CKD (19.9% vs. 9.1%), PAD (19.3% vs. 12.5%), en anemie (24.0% vs. 15.1%) (alle P<0.001), in vergelijking met diegenen zonder verslechterend HF.
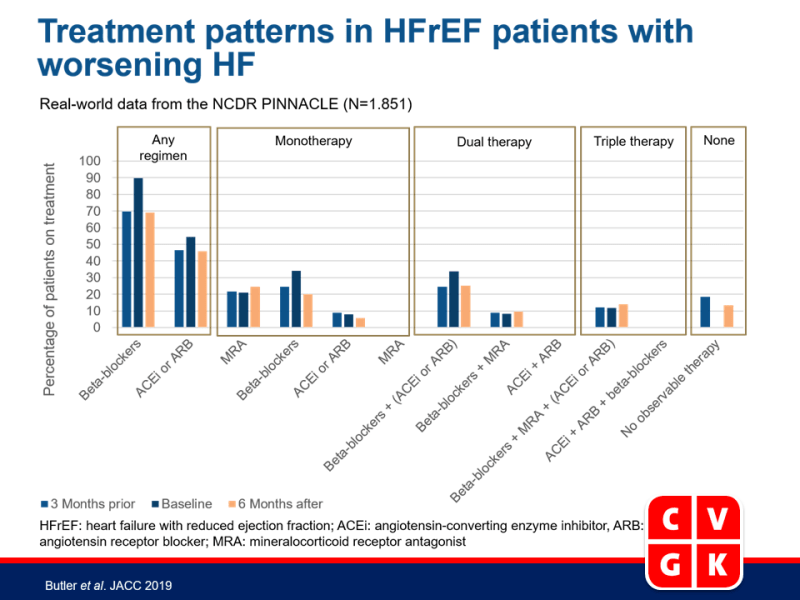
Behandelpatronen
- Op alle drie tijdspunten was het gebruik van bètablokkers hoger dan het gebruik van ACEi/ARB of MRA in patiënten met verslechtend HF, ongeacht het regime.
- Lager gebruik van zowel bètablokkers (89.9% tot 69.1%) als ACEi/ARB (54.6% tot 46.0%) werd gezien 6 maanden na verslechterende HF event. Het gebruik van MRA bleef consistent laag op alle drie tijdspunten (21.2 tot 24.7%).
- Vóór de aanvang van verslechterend HF werd duale therapie gebruikt door 34.1% van de patiënten en drievoudige therapie door 13.7%. Van diegenen met monotherapie (33.7%), namen de meeste patiënten (24.6%) bètablokkers. In totaal nam 18.6% van de patiënten geen van de drie beoordeelde therapieën 3 maanden voor het index verslechterende event.
- Op het moment van het verslechterende event werden vergelijkbare behandelpatronen gezien. Er werd geen merkbaar verschil gezien in behandelpatronen 6 maanden na het verslechterende event, met 13.4% van de patiënten dat geen van de drie beoordeelde geneesmiddelenklassen nam en een kleiner deel (26.0%) dat monotherapie ontving.
- Op alle drie de tijdspunten, nam de helft van de patiënten <50% van de maximale dosis van bètablokkers en ACEi/ARBs.
Uitkomsten
- Het 2-jaars mortaliteitspercentage was 22.5% en de gemiddelde overlevingstijd op basis van een Kaplan-Meier schatting was 19.7 (SD: 0.2) maanden in patiënten met verslechterend HF.
- Op alle drie tijdspunten werd ziekenhuisheropname voor HF gezien in 56%-70% van de patiënten met verslechtend HF en het aantal ziekenheropnames voor HF nam toe in tijd van 0.7 (SD: 0.7) 30 dagen na het verslechterende event tot 2.0 (SD: 2.6) 24 maanden na het verslechterende event.
Conclusie
In de dagelijkse praktijk is verslechterend HF in HFrEF patiënten geassocieerd met grote comorbiditeitslast en slechte uitkomsten. HFrEF patiënten met verslechterend HF hebben mogelijk laag medicatiegebruik en een suboptimaal behandelregime voor en na de ontwikkeling van een event dat HF verslechterde. Deze data wijzen op de noodzaak voor zowel verbeterde farmacotherapie om de ontwikkeling van verslechterend HF te voorkomen of te vertragen, als nieuwe behandelingen in HFrEF patiënten, voornamelijk voor diegenen die intolerant zijn voor beschikbare HF therapieën.
Redactioneel commentaar
Bress en King [6] leggen uit dat HF een gecompliceerd en progressief klinisch syndroom is. Hoewel HFrEF farmacotherapie ziekteprogressie kan voorkomen, is optimalisatie van farmacotherapie uitdagend, vooral omdat het geassocieerd is met het behalen van streefdoseringen. HFrEF patiënten die <50% van de streefdosis halen, hebben een hoger risico op mortaliteit en ziekenhuisopname voor HF.
De vraag is daarom: ‘Waarom worden medicaties niet geïnitieerd of opgetitreerd?’ ondanks richtlijnen voor medische therapie voor HFrEF. De auteurs leggen uit dat het antwoord onvatbaar is en waarschijnlijk meerdere factoren omvat: zorgstelsel (bijv. overgang van zorg tussen klinische en poliklinische bezoeken voor patiënten), zorgverlener (bijv. slechte documentatie of klinische inertie) en patiënt (bijv. fysiologische beperkingen, acceptatie, verzekering en kostenstatus). Deze factoren houden onderling verband en kunnen voortvloeien uit gefragmenteerde zorg tussen verschillende zorgverleners en zorgstelsels. Tegelijkertijd is het moeilijk om onderscheid te maken tussen gepaste en ongepaste passiviteit (bijv. fysiologische beperkingen vs. gebrek aan kennis over het belang van het bereiken van streefdoses). Het is daarom onduidelijk in hoeverre laag medicatiegebruik een kans biedt voor verbetering in de populatie vs. realiteit van fysiologische verdraagbaarheid.
Een andere belangrijke vraag is: ‘Met of zonder verslechterend HF, hoe kunnen we initiatie en titratie van medicatie verbeteren in patiënten met HFrEF?’. De auteurs leggen uit dat hoewel het antwoord niet simpel is, het is aangetoond dat team-gebaseerde zorgbenaderingen, vergelijkbaar met die voor hypertensie, initiatie en titratie van HFrEF medicatie effectief kunnen verbeteren. Het is aangetoond dat team-gebaseerde zorg met een apotheker ziekenhuisopname voor HF verlaagt in vergelijking met standaardzorg, en zowel het percentage patiënten dat ACEis of ARBs en bètablokkers voorgeschreven krijgt als het percentage patiënten met doseringen op streefwaarde of maximale verdraagbare waarde toeneemt. De lopende PHARM-CHF trial zal meer informatie verschaffen over therapietrouw met team-gebaseerde zorg.
Referenties
1. Ambrosy AP, Fonarow GC, Butler J, et al. The global health and economic burden of hospitalizations for heart failure: lessons learned from hospitalized heart failure registries. J Am Coll Cardiol 2014;63:1123–33.
2. Okumura N, Jhund PS, Gong J, et al. Importance of clinical worsening of heart failure treated in the outpatient setting: evidence from the Prospective Comparison of ARNI With ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure Trial (PARADIGM-HF). Circulation 2016; 133:2254–62.
3. Skali H, Dwyer EM, Goldstein R, et al. Prognosis and response to therapy of first inpatient and outpatient heart failure event in a heart failure clinical trial: MADIT-CRT. Eur J Heart Fail 2014;16: 560–5.
4. Rame JE, Sheffield MA, Dries DL, et al. Outcomes after emergency department discharge with a primary diagnosis of heart failure. Am Heart J 2001;142:714–9.
5. Butler J, Braunwald E, Gheorghiade M. Recognizing worsening chronic heart failure as an entity and an end point in clinical trials. JAMA 2014;312:789–90.
6. Bress AP and King JB. Optimizing Medical Therapy in Chronic Worsening HFrEF. A Long Way to Go. JACC 2019;73(8): 945-7
