PCSK9 varianten hebben geen effect op het risico op beroerte
//PCSK9// genetische varianten, die lagere niveaus van LCL-c produceren, zijn niet geassocieerd met het risico op ischemische beroerte, in tegenstelling tot significante associaties met het risico op CHD.
Differential effects of PCSK9 variants on risk of coronary disease and ischaemic strokeLiteratuur - Hopewell JC, Malik R, Valdes-Marquez E, et al. - EHJ 2018;39:354–359
Achtergrond
Lage dichtheid lipoproteïne cholesterol (LDL-c) niveaus zijn geassocieerd met coronaire hartziekte (CHD) en met ischemische beroerte (IS), maar de laatste relatie is niet goed vastgesteld [1]. PCSK9 varianten zijn nuttig om de sterkte van associatie tussen LDL-c en IS te bestuderen.
In deze studie werd de associatie van PCSK9 genetische varianten met IS risico geëvalueerd, in meer dan 10000 goed gekarakteriseerde IS gevallen, en werd de sterkte van associatie vergeleken met die van CHD risico.
Voor dit doel werden de volgende PCSK9 genetische varianten geselecteerd:
- het zeldzame loss-of-function (LOF) missense rs11591147 (R46L) polymorfisme, dat een groot effect heeft op PCSK9- en LDL-c-niveaus en sterk geassocieerd is met CHD [2]
- de veelvoorkomende missense varianten rs562556 [V474I], rs505151 [E670G] en rs11583680 [A53V]
- de veelvoorkomende niet-coderende varianten rs11206510 en rs2479409
De effecten van elke variant op het risico werden afzonderlijk onderzocht en er werd een gewogen genetische risicoscore geconstrueerd met alleen de twee onafhankelijke varianten rs11591147 en rs505151.
Gegevens van 3 genoom-brede meta-analyses werden gebruikt, waaronder 10307 IS gevallen en 19326 controles van Europese afkomst: het Global Lipids Genetics Consortium (GLGC) [10], het CARDIoGRAMPlusC4D Consortium [12], de METASTROKE Collaboration [13].
Belangrijkste resultaten
rs11591147 (R46L), de LOF-variant met lage frequentie (1.5%), was geassocieerd met een 0.5 mmol/L lager LDL-c niveau (95%CI: 0.47-0.54; P=9x10-143) per T-allel.
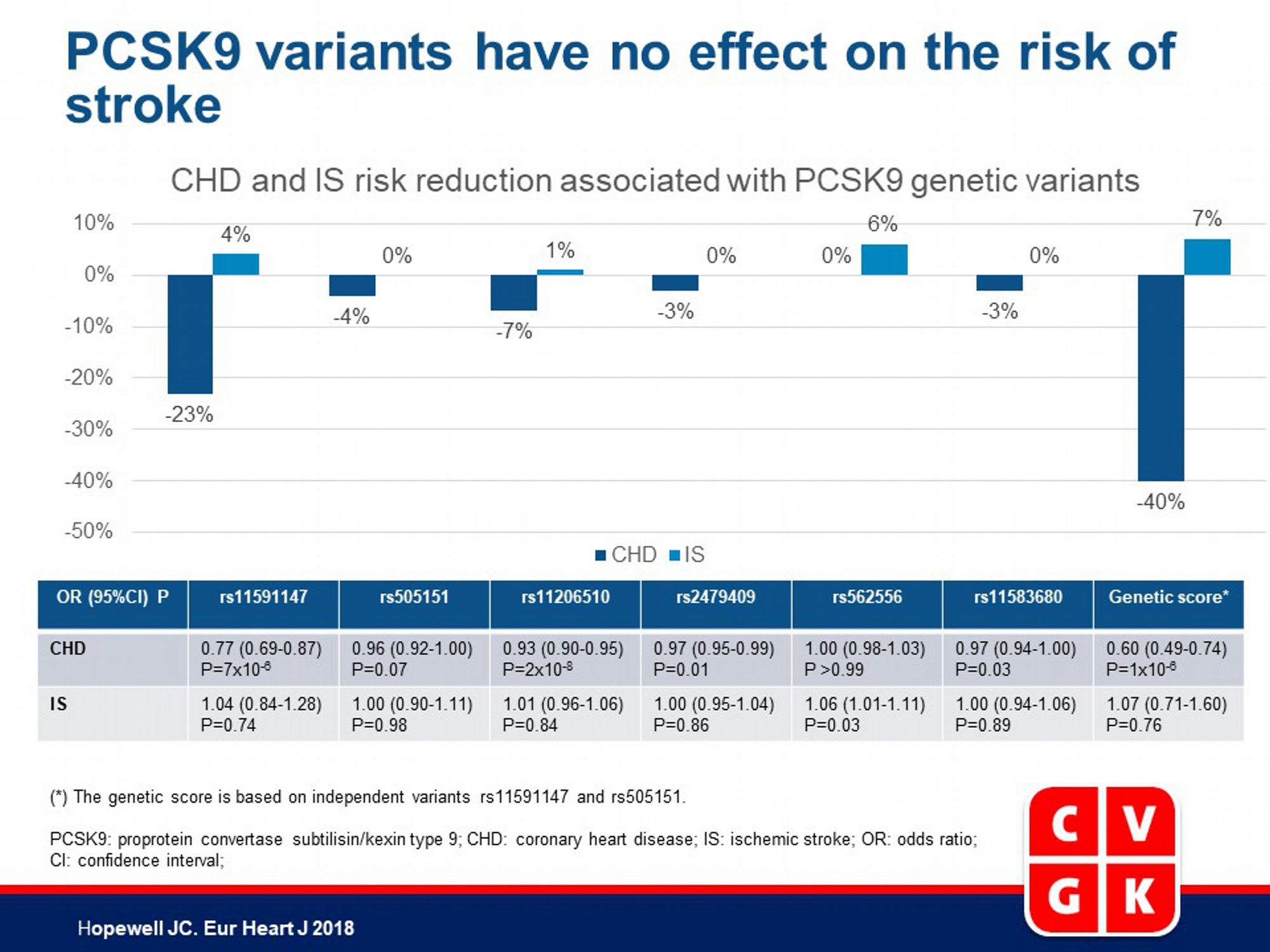
- rs11591147 (R46L) LOF-variant was geassocieerd met een 23% lager risico op CHD (OR: 0.77; 95%CI: 0.69-0.87; P=7x10-6), maar dit was niet geassocieerd met IS risico (OR: 1.04; 95%CI: 0.84-1.28; P=0.74) en er was geen significante heterogeniteit van het effect op IS tussen de bijdragende onderzoeken (P=0.26).
- In het algemeen was de associatie van rs11591147 (R46L) met IS risico significant verschillend van die met CHD risico (P voor heterogeniteit=0.02).
- De vijf extra PCSK9 varianten varieerden in frequentie van 14.1% tot 96.5% voor het LDL-verlagende allel. Elk van de aanvullende PCSK9 varianten was significant geassocieerd met LDL-c niveaus, met effecten variërend van 0.09 mmol/L lagere LDL-c per allel (95%CI: 0.07-0.11; P=4x10-17) voor rs505151 tot 0.03 mmol/L lagere LDL-c per allel (95%CI: 0.02-0.05; P=1x10-8) voor rs11583680.
- Er waren geen duidelijke associaties van een van de andere PCSK9 varianten met IS risico en geen significante heterogeniteit tussen de effecten van alle zes varianten op het IS risico wanneer geschaald naar hetzelfde LDL-c-verschil (P=0.56).
- Er waren ook geen significante associaties van rs11591147 (R46L) of een van de andere PCSK9 varianten met cardio-embolische, grote slagader- of kleine vaatziekte beroerte.
- De PCSK9 genetische risicoscore was geassocieerd met een 40% lager risico op CHD (OR: 0.60; 95% CI: 0.49-0.74; P=1x10-6) en een niet-significant effect op IS (OR: 1.07; 95% CI: 0.71-1.60; P=0.76) per 1 mmol/L lager LDL-c, wat duidt op significante heterogeniteit tussen de effecten van PCSK9 op CHD en op IS risico (P voor heterogeniteit 0.01).
Conclusie
//PCSK9// genetische varianten, die lagere niveaus van LDL-c produceren, zijn niet geassocieerd met het risico van IS, in tegenstelling tot significante associatie met het risico op CHD.
Redactioneel commentaar
Ference [6] concentreert zich in zijn redactionele artikel op de Mendeliaanse randomisatiemethode, in plaats van de bevindingen van de studie gepubliceerd door Hopewell et al. Hij benoemt de beperkingen in de analogie tussen de zogenaamde 'natuur‘s gerandomiseerde trials' (Mendeliaanse gerandomiseerde studie) en een gerandomiseerde studie die de vertaling omvat van het causale effect van levenslange veranderingen in een blootstelling op een uitkomst naar het verwachte effect in reactie op korte-termijn therapeutisch veroorzaakte veranderingen in die blootstelling op de uitkomst. Hij bespreekt eveneens het gevaar van overschatting van de verwachte effectgrootte bij het gebruik van Mendeliaanse randomisatie uitkomsten om de resultaten van een gerandomiseerde studie te voorspellen. De auteur concludeert: “Mendeliaanse randomiseringsstudies kunnen worden gebruikt om nauwkeurig te anticiperen op de resultaten van gerandomiseerde studies. Een veelgehoorde misvatting is echter dat een therapie gericht tegen iedere causale blootstelling waarschijnlijk de bijbehorende uitkomst zal verbeteren. Helaas geeft het vaststellen dat een blootstelling causaal verband houdt met een uitkomst ons vrijwel geen informatie over de vraag of een therapie die is gericht tegen die blootstelling de uitkomst zal verbeteren in een gerandomiseerde studie. Om te anticiperen op de resultaten van een gerandomiseerde studie, is de kritische vraag die moet worden beantwoord, in hoeverre de causale blootstelling moet worden gewijzigd om de bijbehorende uitkomst te verbeteren in een kortlopende gerandomiseerde studie.”
Referenties
1. The Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376:1670–1681.
2. Cohen JC, Boerwinkle E, Mosley TH Jr, et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006;354:1264–1272.
3. The Global Lipids Genetics Consortium. Discovery and refinement of loci associated with lipid levels. Nat Genet 2013;45:1274–1283.
4. The CARDIoGRAMplusC4D Consortium. A comprehensive 1000 Genomes based genome-wide association meta-analysis of coronary artery disease. Nat Genet 2015;47:1121–1130.
5. Malik R, Traylor M, Pulit SL, et al. Low-frequency and common genetic variation in ischemic stroke: the METASTROKE collaboration. Neurology 2016;86:1217–1226.
6. Ference BA. How to use Mendelian randomization to anticipate the results of randomized trials. European Heart Journal (2018) 39, 360–362.
Download de slideVind dit artikel online op European Heart Journal 2018