Ezetimibe met statines: effecten op markers en LDL
05/12/2012
Deze post-hoc analyse van de EASE-studie evalueert effecten van ezetimibe toegevoegd aan verschillende statinetherapieën op het verlagen van LDL-C en markers van cholesterolabsorptie en -synthese.
Effects of ezetimibe added to statin therapy on markers of cholesterol absorption and synthesis and LDL-C lowering in hyperlipidemic patients.Literatuur - Thongtang N et al. Atherosclerosis. 2012;225:388-96
Thongtang N, Lin J, Schaefer EJ, Lowe RS, Tomassini JE, Shah AK, Tershakovec AM.
Atherosclerosis. 2012;225:388-96. doi: 10.1016/j.atherosclerosis.2012.09.001.
Achtergrond
Een groot aantal patiënten behandeld met een statine hebben nog steeds LDL-C niveaus boven doelstellingen aanbevolen in de richtlijnen [1-4]. Statines hebben niet alleen een direct remmend effect op cholesterolsynthese, maar verminderen ook markers van cholesterolsynthese, zoals lathosterol, wat daaropvolgende stijgingen van markers van cholesterolabsorptie aan het licht kan brengen [5-9], afhankelijk van de dosering en het type statine.Ezetimibe is een selectieve remmer van cholesterol- absorptie die het transport van cholesterol en fytosterolen via de darmwand blokkeert, waardoor LDL-C aanzienlijk wordt verminderd met 15-20% [10,11]. Gelijktijdige toediening van ezetimibe samen met een statine remt de absorptie en de synthese van cholesterol [12], wat een significant grotere vermindering van LDL-C geeft dan elk afzonderlijk middel [11,13,14].
In deze post-hoc analyse van de EASE (Ezetimibe Add-on to Statin for Effectiveness) studie werden de effecten geëvalueerd van het toevoegen van ezetimibe 10 mg aan verschillende statines en doseringen op plasma lipiden-verlagende effecten en non-cholesterol sterolenniveaus. Vergelijking was gebaseerd op statine-type of potentie (Laag, gemiddeld, hoog) subgroepen. De lage-potentie statine groep omvatte patiënten die simvastatine ≤ 10 mg / dag, lovastatine ≤ 20 mg / dag, pravastatine ≤ 20 mg / dag, of fluvastatine ≤ 40 mg / dag kregen. De gemiddelde-potentie statine groep omvatte patiënten die simvastatine> 10 - ≤ 40 mg / dag, atorvastatine ≤ 20 mg / dag, lovastatine> 20-80 mg / dag, pravastatine> 20-80 mg / dag, of fluvastatine> 40 tot 80 mg / dag kregen. De hoge-potentie statine groep omvatte patiënten die simvastatine> 40 tot 80 mg / dag, of atorvastatine> 20-80 mg / dag kregen.
Lipiden- en non cholesterol -sterolendata uit de ezetimibe arm van deze studie werden gebruikt om de hypothese te testen dat ezetimibe, wanneer toegevoegd aan statine, het meest effectief is in het verlagen van LDL-C bij hoogpotente statines en dat deze effecten gerelateerd zijn aan veranderingen in markers van cholesterol absorptie (b-sitosterol, b-sitosterol/cholesterol) en synthese (lathosterol, lathosterol / cholesterol).
Belangrijkste resultaten
- Dosering en type statine zijn significant geassocieerd met de niveaus van markers van cholesterol synthese en absorptie
- De toevoeging van ezetimibe aan alle statine soorten resulteerde in aanzienlijke verlagingen ten opzichte van baseline in totaal cholesterol, LDL-C, non-HDL-C, Apo B, C en totaal / HDL-C, zonder verschillen tussen types statines (fig. 1 ).
- Ezetimibe therapie bovenop statinetherapie resulteerde in een significante toename van markers van cholesterol synthese en significante vermindering van markers van absorptie van cholesterol ten opzichte van baseline voor elke statine-type en statine potentie.
Conclusie
Deze resultaten onderstrepen de complementaire effecten van statines en ezetimibe bij het moduleren van markers van cholesterol synthese en absorptie. Patiënten op (hoogpotente) statines zijn wellicht goede kandidaten voor ezetimibe therapie als extra LDL-C verlaging nodig is om LDL-C doelen te bereiken.Download als PPT
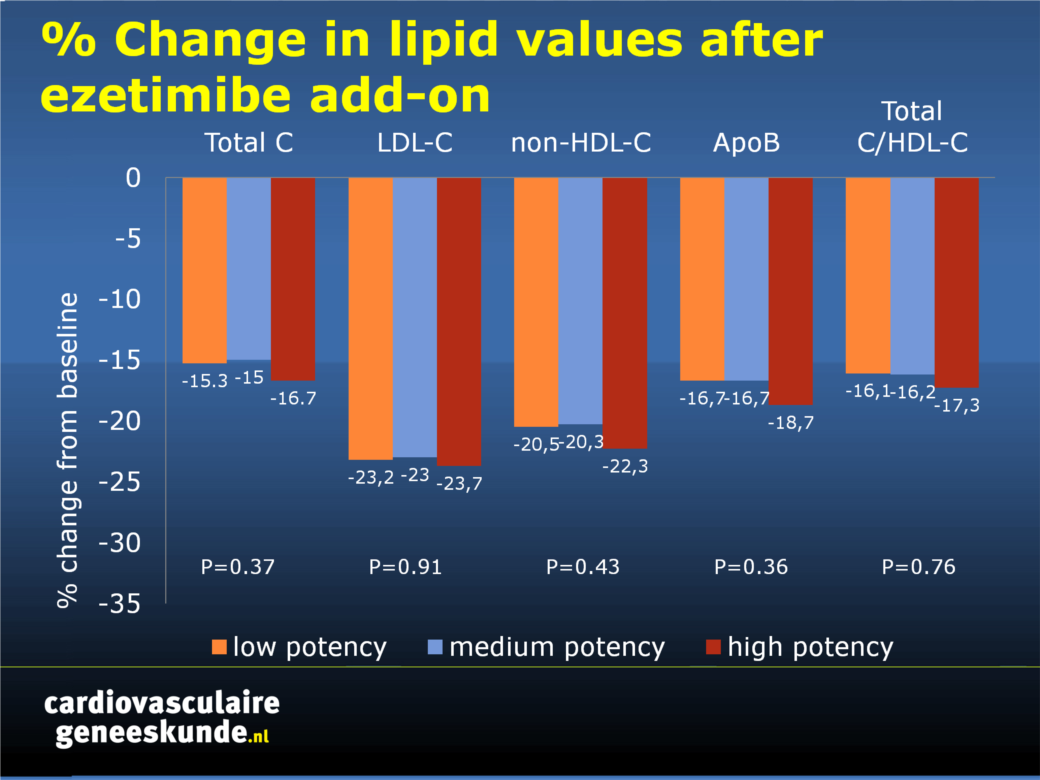
Fig. 1. Percentage verandering in lipidenwaarden ten opzichte van baseline op statine na toevoeging van ezetimibe (gecorrigeerd voor waarden uit de placebo-arm van EASE).
Referenties
1. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection. Evaluation, and treatment of high blood cholesterol in adults (adult treatment panel III) final report. Circulation 2002;106:3143e421.2. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the national cholesterol education program adult treatment panel III guidelines. Circulation 2004;110:227e39.
3. Catapano AL, Reiner Z, De Backer G, et al. ESC/EAS guidelines for the management of dyslipidaemias the task force for the management of dyslipidaemias of the European society of cardiology (ESC) and the European atherosclerosis society (EAS). Atherosclerosis 2011;217:3e46.
4. Perk J, De Backer G, Gohlke H, et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012): the fifth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts) developed with the special contribution of the European association for cardiovascular prevention & rehabilitation (EACPR). Eur Heart J 2012;33:1635e701.
5. Reihnér E, Rudling M, Stáhlberg D, et al. Influence of pravastatin, a specific inhibitor of HMG-CoA reductase, on hepatic metabolism of cholesterol. N Engl J Med 1990;323:224e8.
6. Lamon-Fava S, Diffenderfer MR, Barrett PH, et al. Effects of different doses of atorvastatin on human apolipoprotein B-100, B-48, and A-I metabolism. J Lipid Res 2007;48:1746e53.
7. Vanhanen H, Miettinen TA. Pravastatin and lovastatin similarly reduce serum cholesterol and its precursor levels in familial hypercholesterolaemia. Eur J Clin Pharmacol 1992;42:127e30.
8. Ooi EM, Barrett PH, Chan DC, Nestel PJ, Watts GF. Dose-dependent effect of rosuvastatin on apolipoprotein B-100 kinetics in the metabolic syndrome. Atherosclerosis 2008;197:139e46.
9. De Cuyper I, Wolthers BG, van Doormaal JJ, Wijnandts PN. Determination of changes in serum lathosterol during treatment with simvastatin to evaluate the role of lathosterol as a parameter for whole body cholesterol synthesis. Clin Chim Acta 1993;219:123e30.
10. Davidson MH, McGarry T, Bettis R, et al. Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia. J Am Coll Cardiol 2002;40:2125e34.
11. Gagne C, Gaudet D, Bruckert E. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation 2002;105:2469e75.
12. Gouni-Berthold I, Berthold HK, Gylling H, et al. Effects of ezetimibe and/or simvastatin on LDL receptor protein expression and on LDL receptor and HMG-CoA reductase gene expression: a randomized trial in healthy men. Atherosclerosis 2008;198:198e207.
13. Ballantyne CM, Houri J, Notarbartolo A, et al. Effect of ezetimibe coadministered with atorvastatin in 628 patients with primary hypercholesterolemia: a prospective, randomized, double-blind trial. Circulation 2003;107:2409e15.
14. Morrone D, Weintraub WS, Toth PP, et al. Lipid-altering efficacy of ezetimibe plus statin and statin monotherapy and identification of factors associated with treatment response: a pooled analysis of over 21,000 subjects from 27 clinical trials. Atherosclerosis 2012;223:251e61.
Abstract
Objective:
Statins inhibit cholesterol synthesis but can upregulate cholesterol absorption, with higher doses producing larger effects. Ezetimibe inhibits cholesterol absorption but also upregulates synthesis. We tested whether ezetimibe added to on-going statin therapy would be most effective in lowering LDL-cholesterol (LDL-C) in subjects on high-potency statins and whether these effects would be related to alterations in cholesterol absorption (β-sitosterol) and synthesis (lathosterol) markers.
Methods:
Hypercholesterolemic subjects (n = 874) on statins received ezetimibe 10 mg/day. Plasma lipids, lathosterol, and β-sitosterol were measured at baseline and on treatment. Subjects were divided into low- (n = 133), medium- (n = 582), and high- (n = 159) statin potency groups defined by predicted LDL-C-lowering effects of each ongoing statin type and dose (reductions of ∼20-30%, ∼31-45%, or ∼46-55%, respectively).
Results:
The high-potency group had significantly lower baseline lathosterol (1.93 vs. 2.58 vs. 3.17 μmol/l; p < 0.001) and higher baseline β-sitosterol values (6.21 vs. 4.58 vs. 4.51 μmol/l, p < 0.001) than medium-/low-potency groups. Ezetimibe treatment in the high-potency group produced significantly greater reductions from baseline in LDL-C than medium-/low-potency groups (-29.1% vs. -25.0% vs. -22.7%; p < 0.001) when evaluating unadjusted data. These effects and group differences were significantly (p < 0.05) related to greater β-sitosterol reductions and smaller lathosterol increases. However, LDL-C reduction differences between groups were no longer significant after controlling for placebo effects, due mainly to modest LDL-C lowering by placebo in the high-potency group.
Conclusion:
Patients on high-potency statins have the lowest levels of cholesterol synthesis markers and the highest levels of cholesterol absorption markers at baseline, and the greatest reduction in absorption markers and the smallest increases in synthesis markers with ezetimibe addition. Therefore, such patients may be good candidates for ezetimibe therapy if additional LDL-C lowering is needed.
